Chymotrypsyna - do czego służy?
Co to jest chymotrypsyna?
Chymotrypsyna to enzym odgrywający rolę w procesie trawienia w organizmie człowieka. Jako enzym ma za zadanie rozkładać białka z pożywienia i rozbijać je na drobne składniki - tak zwane oligopeptydy - które następnie mogą być wchłaniane w jelicie. Chymotrypsyna jest wytwarzana w trzustce i wraz z innymi enzymami trawiennymi, takimi jak trypsyna, pepsyna czy karboksypeptydazy, odgrywa ważną rolę we wchłanianiu białek.
Aby uzyskać więcej informacji na temat karboksypeptydaz, przeczytaj nasz artykuł: Karboksypeptydaza

Funkcja chymotrypsyny
Chymotrypsyna jest enzymem trzustki (trzustka), który jest odpowiedzialny za siekanie i rozbijanie białek spożywanych z pożywieniem. Białka są przekształcane w tak zwane oligopeptydy (Skład mniej niż 10 aminokwasów) rozszczepiają się, dzięki czemu mogą być łatwiej wchłaniane przez błonę śluzową jelita cienkiego i wprowadzane do krążenia. W ten sposób organizm może wchłonąć ważne składniki z pokarmów zawierających białko, takich jak orzechy, pieczywo pełnoziarniste, drób czy ryby. To z kolei jest ważne, aby organizm mógł go wykorzystać do budowy własnych białek. Należą do nich na przykład hormony i przeciwciała dla układu odpornościowego, ale także białka do krzepnięcia krwi, budowy mięśni, włosów i paznokci.
Chymotrypsyna jest endopeptydazą. Endopeptydazy to enzymy odpowiedzialne za zrywanie wiązań między poszczególnymi aminokwasami, wiązań peptydowych. Pozwala to na rozbicie białek z pożywienia na fragmenty peptydów. Są one z kolei rozkładane na poszczególne aminokwasy przez inne peptydazy.
Jako endopeptydaza chymotrypsyna należy do grupy proteaz serynowych. Oznacza to, że aminokwas seryna znajduje się w tzw. Centrum aktywnym, czyli głównym obszarze roboczym enzymu. To ma pewną grupę (Grupa hydroksylowa), co jest ważne przy zrywaniu wiązania peptydowego.
Białka, które miażdży chymotrypsyna, są zawsze rozszczepiane w określonych pozycjach w sekwencji aminokwasów. Są to tak zwane aminokwasy aromatyczne fenyloalanina, tryptofan i tyrozyna.
Funkcja rozszczepiania chymotrypsyny odgrywa również w medycynie rolę w rozkładaniu kompleksów immunologicznych, które mogą uszkadzać organizm. Ponadto chymotrypsyna może łagodzić stany zapalne lub bóle układu mięśniowo-szkieletowego. Redukuje klasyczne objawy zapalenia, takie jak obrzęk czy miejscowe zaczerwienienie skóry. Czasami jest również używany do rozpuszczania śluzu w zapaleniu płuc lub astmie.
Jakie są formy chymotrypsyny?
W efekcie chymotrypsyna to rodzina różnych form. Wszystkie mają wspólną cechę, że są to proteazy serynowe z trzustki.
Przede wszystkim należy rozróżnić formę nieaktywną i aktywną. W trzustce nieaktywny prekursor (tak zwany zymogen) wykonane z chymotrypsyny, zwanej chymotrypsynogenem. Jeśli zostanie uwolniony z trzustki i dotrze do jelita cienkiego, może zostać rozłożony przez trypsynę, inny enzym trzustki, i przekształcony w aktywną chymotrypsynę. Chymptrypsynogen jest podzielony na trzy części.
Ponadto można rozróżnić chymotrypsynę A, B1, B2 i C. Najbardziej odpowiednimi formami dla organizmu ludzkiego są chymotrypsyna B1 i chymotrypsyna B2. Postać chymotrypsyny C odkryto w trzustce świń pozbawionych formy B.
Może Cię również zainteresować: Trypsyna
Czym różnią się różne formy?
Poszczególne formy chymotrypsyny to wszystkie proteazy serynowe, w których centrum aktywnym (to tutaj ma miejsce główna aktywność enzymu) znajduje się aminokwas seryna. Różnice między formami wynikają z budowy, punktów, w których białka są rozszczepiane (rozszczepienie lub specyficzność substratowa) oraz aktywności.
Chymotrypsynogen będący prekursorem jest nieaktywny i niezdolny do rozszczepiania białek na ich wiązaniach peptydowych.Z drugiej strony sama chymotrypsyna jest aktywna i zdolna do działania dzięki rozszczepieniu przez trypsynę.
Wszystkie formy dzielą białka na aminokwasy tyrozynę i tryptofan. Chymotrypsyna B rozszczepia również inne wiązania, które znajdują się na przykład w cząsteczce glukagonu.
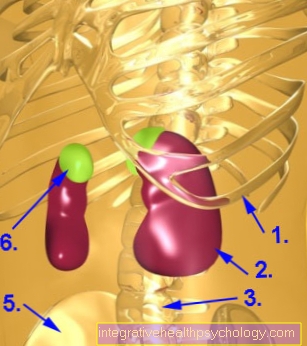
Gdzie powstaje chymotrypsyna?
Chymotrypsyna powstaje w trzustce, tzw. Zewnątrzwydzielniczej części trzustki. Tam chymotrypsyna jest początkowo nieaktywna we wstępnym etapie (Zymogen) wyprodukowano. Ta forma zymogenu jest również nazywana chymotrypsynogenem. Jeśli chymotrypsynogen dociera do jelita cienkiego, jest następnie dzielony na trzy różne części przez enzym trzustkowy trypsynę, w wyniku czego powstaje również aktywna chymotrypsyna.
Może Cię również zainteresować: Trypsyna
Przy jakiej wartości pH chymotrypsyna działa najlepiej?
Ponieważ chymotrypsyna może działać prawidłowo jako enzym trawienny tylko przy określonej wartości pH, ważne jest, aby wartości pH w odcinku żołądkowo-jelitowym pozostawały w miarę stałe. Chymotrypsyna działa przy pH między 7 a 9, które zwykle mieści się w zakresie pH całego jelita cienkiego.
Jak określa się wartość chymotrypsyny?
Do określenia poziomu chymotrypsyny wymagana jest próbka kału. W tym przypadku aktywność chymotrypsyny określa się za pomocą tak zwanej fotometrii. Za pomocą specjalnego urządzenia, które może mierzyć określone długości fal w postaci absorpcji światła, sprawdza się próbkę kału, aby sprawdzić, czy i, jeśli tak, to w jakim stopniu chymotrypsyna jest aktywna. Ta metoda pomiaru jest również stosowana w medycynie do wielu innych pomiarów.
Jakie są normalne wartości?
U zdrowej osoby pomiar aktywności chymotrypsyny wynosi ponad 6 U / g (jednostki na gram kału). Jeśli wartość mieści się w przedziale od 3 do 6 U / g, należy jak najszybciej ponownie sprawdzić ten wynik. Jeśli wartość jest niższa niż 3 U / g, jest to z całą pewnością wskazanie na chorobę trzustki, która prowadzi do niedoboru chymotrypsyny.
Przeczytaj także: To są objawy choroby trzustki!
Niedobór chymotrypsyny
Co się stanie, jeśli zabraknie chymotrypsyny?
Jeśli występuje niedobór chymotrypsyny, białka ze spożytego pożywienia mogą być tylko w niewystarczającym stopniu rozłożone, a ważne składniki odżywcze nie mogą już być wchłaniane w wystarczającym stężeniu. W efekcie dochodzi do zaburzenia całej błony śluzowej jelita, dochodzi do przerostu bakterii, zapalenia i regresji powierzchni (Zanik kosmków jelita cienkiego). Ponadto brak wchłaniania prowadzi do utraty wagi i objawów niedoboru, ponieważ ważnych białek z pożywienia nie można już rozkładać i wprowadzać do krążenia.
Przyczyny niedoboru
Niedobór chymotrypsyny może wynikać z tak zwanej zewnątrzwydzielniczej niewydolności trzustki. Oznacza to, że część trzustki odpowiedzialna za produkcję enzymów trawiennych, w tym chymotrypsyny, ulega uszkodzeniu. Z kolei zewnątrzwydzielnicza niewydolność trzustki może mieć różne przyczyny, np. Mukowiscydozę (Mukowiscydoza), zapalenie trzustki (Zapalenie trzustki), Kamienie żółciowe, nadużywanie alkoholu lub infekcje. Innymi możliwymi przyczynami mogą być guzy trzustki lub różne leki.
Jeśli jednak podejrzewa się jedną z wymienionych chorób, należy również podjąć inne środki diagnostyczne w celu wyjaśnienia sytuacji.
Aby uzyskać więcej informacji, zobacz: Niewydolność trzustki
Co możesz zrobić w przypadku niedoboru?
Brak chymotrypsyny można zrekompensować podając preparaty enzymatyczne. Są to suplementy enzymatyczne dla trzustki, czyli tabletki zawierające kilka enzymów, które normalnie są wytwarzane w trzustce. Należy to jednak robić tylko w ścisłej konsultacji z lekarzem, gdyż w przypadku niedoboru chymotrypsyny należy zawsze leczyć przyczynę tego niedoboru, czyli zewnątrzwydzielniczą niewydolność trzustki. Preparaty enzymatyczne należy przyjmować z posiłkami, aby spożytą żywność można było bezpośrednio rozłożyć.
Przeczytaj więcej o: Niewydolność trzustki


.jpg)