Trypsynogen
Definicja - Co to jest trypsynogen?
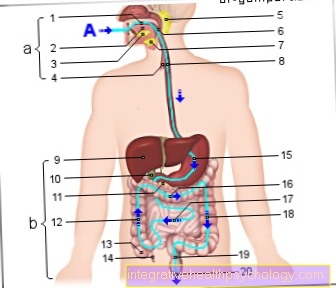
Trypsynogen jest nieaktywnym prekursorem, tzw Proenzyme, enzym wytwarzany w trzustce, zwany trzustką. Wraz z pozostałą wydzieliną trzustkową, tzw. Trzustką, proenzym trypsynogen jest uwalniany przewodami trzustkowymi do dwunastnicy, czyli części jelita cienkiego. Tutaj następuje aktywacja enzymu trypsyny.
Ten enzym nazywa się „Hydrolaza„skategoryzowane, czyli jest w stanie rozdzielić połączenia pomiędzy poszczególnymi aminokwasami. Proces ten zachodzi w Jelito cienkie zamiast tego rozkłada białka wchłaniane z pożywieniem na mniejsze fragmenty aminokwasów, co umożliwia ich wchłanianie do organizmu.

Jak przebiega aktywacja trypsyny?
Aktywacja trypsynogenu do trypsyny może odbywać się na dwa różne sposoby. W obu przypadkach aktywacja nie zachodzi w okolicy trzustki lub jej przewodów, a jedynie w okolicy dwunastnicy, czyli części jelita cienkiego.
- Dla jednej możliwości aktywacji trypsyny wymagany jest inny enzym. Enzym ten jest wytwarzany w rąbku szczoteczkowym, czyli w powierzchownych komórkach dwunastnicy. To jest nazwane Enteropeptydaza lub Enterokinaza. Enzym należy do Hydrolazy skategoryzowane. Oznacza to, że mogą odwracalnie rozszczepiać związki poszczególnych aminokwasów, które nadają proenzymowi trypsynogenowi strukturę, konsumując cząsteczki wody. Kiedy trypsynogen jest aktywowany do trypsyny, łańcuch sześciu aminokwasów, tak zwany heksapeptyd, zostaje oddzielony od proenzymu trypsynogenu podczas spożywania wody. Powoduje to skrócenie łańcucha aminokwasów w porównaniu do wcześniejszych. Proces nazywa się ograniczona proteoliza. Jednak enzym jest teraz w swojej aktywnej postaci i może rozszczepiać dalsze łańcuchy aminokwasów, aby móc rozkładać i trawić białka.
- Drugi wariant aktywacji trypsynogenu do trypsyny jest reprezentowany przez już aktywny enzym trypsynę. Trypsyna może nie tylko rozszczepiać obce białka na mniejsze łańcuchy aminokwasów, ale może również skracać własne proenzymy organizmu, takie jak trypsynogen, o kilka aminokwasów. Trypsyna szczególnie lubi rozpadać się po szóstym aminokwasie trypsynogenu. Oznacza to, że odszczepiany jest heksapeptyd, który przekształca trypsynogen w jego aktywną formę - trypsynę. Oprócz trypsynogenu aktywna trypsyna może przekształcić trzy inne enzymy, które są ważne dla trawienia, w ich aktywną formę. Dla aktywacji ważne są również dwa czynniki, które nie są początkowo oczywiste. Z jednej strony działanie trypsyny jest szczególnie dobre przy lekko zasadowej wartości pH od 7 do 8, co oznacza, że trypsynogen jest coraz bardziej aktywowany. Z drugiej strony trypsynogen jest uwalniany w trzustce wraz z inhibitorem trypsyny. Zapobiega to przedwczesnej aktywacji w trzustce i ulega rozpadowi tylko w dwunastnicy.
Gdzie jest wytwarzany trypsynogen?
Proenzym trypsynogen jest z grubsza formułowany w trzustce. To kłamstwo przez górną część brzucha po lewej stronie żołądka. Trzustkę można jeszcze podzielić na dwie części:
- Z część endokrynologiczna produkuje hormony, takie jak insulina do regulacji równowagi cukrów, które działają w organizmie.
- Z część zewnątrzwydzielniczaktóry stanowi większość trzustki, wytwarza trzustkę, która jest proenzymem Trypsynogen i odgrywa ważną rolę w trawieniu.
Może Cię również zainteresować: Funkcje trzustki
Jakie są normalne wartości?
Ponieważ trypsynogen jest normalnie przenoszony przez przewody trzustki bezpośrednio do jelita cienkiego, we krwi zwykle nie ma trypsynogenu, co oznacza, że normalne wartości zbliżają się do zera.
Jeśli jest tak, że trypsynogen jest wykrywany we krwi, odkrycie to zdecydowanie przemawia za procesem patologicznym. Tutaj, na przykład, pojawia się ostry Zapalenie trzustki i a Mukowiscydoza w pytaniu. Trypsyna jest badana w ramach badań przesiewowych noworodków.
Co trypsynogen ma wspólnego z mukowiscydozą?
W mukowiscydozie, zwanej także mukowiscydozą, mutacja w genomie powoduje zmianę składu wydzieliny gruczołów, które uwalniają swoją wydzielinę na powierzchnię organizmu, np. Jelita. Wydzielina staje się znacznie bardziej lepka, co oznacza, że może być uwalniana wolniej.
Ma to szczególne znaczenie w przypadku trzustki. Ze względu na dłuższy czas przebywania w kanałach trzustki wydzielina ma zwiększone działanie w obrębie narządu. Ponieważ trypsynogen jest również coraz bardziej aktywowany do trypsyny, następuje trawienie własnego organizmu, co może skutkować ostrym zapaleniem trzustki.
Więcej informacji na ten temat można znaleźć tutaj: Mukowiscydoza
Co to jest trypsyna?
Trypsyna jest enzymem, który powstaje z nieaktywnego prekursora, proenzymu trypsynogenu, i odgrywa ważną rolę w trawieniu białek. Proenzym trypsynogen pochodzi z zewnątrzwydzielniczej części trzustki. Ten proenzym jest aktywowany na dwa różne sposoby. Z jednej strony przy pomocy enzymu enteropeptydazy odszczepiany jest łańcuch aminokwasowy złożony z sześciu aminokwasów. Z drugiej strony trypsyna może się aktywować. Tutaj również łańcuch aminokwasowy złożony z sześciu aminokwasów jest odszczepiany. Aktywna trypsyna może również działać na trzy proenzymy Prokarboksypeptydazy, Proaminopeptydazy i Chymotrypsynogen przekształcić się w swoje trzy aktywne enzymy poprzez odszczepienie łańcucha aminokwasowego. Te trzy enzymy są również zaangażowane w trawienie białek.
Trypsyna jest klasyfikowana jako enzym w kategorii Hydrolazy skategoryzowane. Oznacza to, że mogą odwracalnie rozdzielać połączenia między aminokwasami poprzez spożywanie wody. Zdolność do rozszczepiania łańcuchów aminokwasów osiąga maksimum w lekko zasadowej trzustce o pH między 7 a 8. Ta właściwość jest niezbędna dla procesu trawienia.
Po enzymach w ślinie jamy ustnej trypsyna stanowi drugi etap rozszczepiania białek. Enzym nie rozszczepia łańcucha aminokwasowego białek z zewnątrz, ale raczej dzieli cały łańcuch na kilka małych fragmentów, które są następnie skracane przez inne enzymy, dzięki czemu są może być wchłaniany do organizmu przez błonę śluzową jelit.
Więcej informacji można znaleźć tutaj: Trypsyna
Co dzieje się z niedoborem trypsyny?
Przy braku trypsyny trawienie białek jest zaburzone. W dalszej części organizm wchłania mniej aminokwasów. Ponieważ niektóre aminokwasy są niezbędne dla organizmu człowieka, ponieważ nie można ich wyprodukować ani przez modyfikację istniejących aminokwasów, ani przez ich własną syntezę, po pewnym czasie pojawiają się objawy niedoboru, które nieleczone mogą mieć poważne konsekwencje.
Ponadto może się zdarzyć, że zostaną wykorzystane zapasy aminokwasów organizmu, takie jak białka w mięśniach, co prowadzi do utraty wagi i zmniejszenia sprężystości.
Niedobór alfa-1 antytrypsyny
Niedobór alfa-1 antytrypsyny jest często spowodowany defektem genetycznym. Alfa-1-antytrypsyna jest enzymem, który hamuje działanie innych enzymów. Enzymy, które są hamowane w tym procesie, zwykle mają za zadanie rozkładać białka, przez co tracą one swoją funkcję. Zatem Alfa-1-Antytrypsyna może być również stosowana jako Inhibitor proteinazy są wyznaczone.
Enzymy hamowane przez Alfa-1-Antytrypsynę występują głównie w procesach zapalnych i głównie Chymotrypsyna, trypsyna, plazmina, elastaza i Trombina.
Szczególnie ważne jest tutaj hamowanie elastazy. Z reguły elastaza rozkłada elastynę, która znajduje się głównie w płucach. Elastyna to białko strukturalne, które w dużej mierze odpowiada za elastyczność płuc. Jeśli brakuje inhibitorów elastazy, takich jak alfa-1-antytrypsyna, może to prowadzić do zwiększonej aktywności elastazy w płucach. Tutaj, podobnie jak wszędzie indziej w organizmie, elastaza rozkłada białka, ale wpływa to na tkankę własną organizmu w płucach. Prowadzi to do masywnego uszkodzenia tkanki płucnej, co nieuchronnie ogranicza czynność płuc. Objawy, które się z tego wynikają, obejmują Kaszel, duszność i zwężenie dróg oddechowych. Ponadto wątroba, która jest głównie odpowiedzialna za produkcję elastazy, może wykazywać podwyższone wartości wątrobowe i być dalej uszkadzana przez przekrwienie dróg żółciowych.
Więcej informacji można znaleźć tutaj: Niedobór alfa-1 antytrypsyny
Rekomendacje naszego zespołu redakcyjnego
- Trypsyna
- Alfa-1 antytrypsyna
- Niedobór alfa-1 antytrypsyny
- Chymotrypsyna - do czego służy?
- Rola enzymów w organizmie człowieka